新聞資訊
NEWS CENTER
- 干貨:醫用手套出口需要
- 亞馬遜FBA倉庫查詢
- 口罩出口需要什么認證
- 進出口木箱包裝的標準及
- 口罩出口稅率是多少?附
- 國際空運的運價種類有什
- 干貨:防護面罩出口需要
- 防護服出口需要什么資質
- 家具出口需要什么手續及
- 重磅!消毒液出口需要什
- 熔噴布現在可以出口嗎?
- 現在口罩可以出口嗎?新
- 2020年進出口貿易數據!
- 口罩等防疫用品出口白名
- 汽車配件出口需要什么手
- 干貨!口罩機出口國外要
- 出口退稅主要類型及案例
- 食品出口需要什么資質及
- 進出口報關,客戶發票低
- 國際物流,各大國際快遞
- 重磅!醫用口罩出口和非
- 新型冠狀病毒疫情期間,
- 一次性手套出口到美國要
- 口罩出口需要哪些資質?
- 重點!呼吸機出口所需要
- 呼吸機出口需要什么資質
- 國際海運,散貨拼箱常見
- n95口罩出口需要什么資質
- 防護服出口需要什么資質
- 現在口罩允許出口嗎?中
- 【通知】這類貨物訂艙有
- 清關延遲,你單證出問題
- 國際物流,鐵路貨物運輸
- 新型冠狀病毒疫情期間,
- 外貿綜合服務業務發票的
- 醫療物資出口需要什么資
- 國際快遞,美國聯邦快遞
- 海關總署公告2017年第6
- 電子委托進出口報關及海
- 口罩出口所需流程以及必
防護服出口需要什么資質及認證?看這篇!
作者:巨東物流??|??發布時間:2020-04-29 11:35??|??來源:物流資訊????關注量:
文章摘要: 那么,這篇文章我們就具體來講一下防護服的出口流程。 1禁限管理 目前商務部未對防護服設置貿易管制要求,中國海關也無針對防護服物資的監管證件口岸驗核要求。 2出口資質 國內出口貿易企業需具備的資質和材料: 1.營業執照(經營范圍有相關經營內容)。 2.企業生產許可證(生產企業)。 3.產品檢驗報告(生產企業)。 4.醫療器械注冊證(非醫用不需要)。 5.產品說明書(跟著產品提供)、標簽(隨附產品提供)。 6.產品批次/號(外包
那么,這篇文章我們就具體來講一下防護服的出口流程。
1 禁限管理
目前商務部未對防護服設置貿易管制要求,中國海關也無針對防護服物資的監管證件口岸驗核要求。
2 出口資質
國內出口貿易企業需具備的資質和材料:
1.營業執照(經營范圍有相關經營內容)。
2.企業生產許可證(生產企業)。
3.產品檢驗報告(生產企業)。
4.醫療器械注冊證(非醫用不需要)。
5.產品說明書(跟著產品提供)、標簽(隨附產品提供)。
6.產品批次/號(外包裝)。
7.產品質量安全書或合格證(跟著產品提供)。
8.產品樣品圖片及外包裝圖片。
9.貿易公司須取得海關收發貨人注冊備案。
國內生產企業出口資質證明:
生產醫用防護服用于出口,中國海關不需要企業提供相關資質證明文件,但一般進口國會要求生產企業提供產品三證,以證明該進口的商品在中國已合法上市,具體如下:
1.營業執照(經營范圍包含有醫療器械相關)。
2.醫療器械產品備案證或者注冊證。
3. 廠家檢測報告。
生產企業有進出口權,可以自行出口,如沒有進出口權,可以通過外貿代理進行出口銷售。
3 商品歸類
除特殊情況外,絕大部分防護服按照材質分類應歸入下列稅號:
4 出口退稅
防護服的出口退稅率為13%。
5 原產地優惠
中國已經和25個國家或地區簽署了17個自由貿易協定,中國原產的商品,包括疫情防控物資,出口到這些國家和地區憑優惠原產地證書可以獲得關稅減免優惠。
以出口防護服到韓國為例,可以看到關稅減免的幅度是很大的,所以建議出口前向海關申請原產地證書。
6 產品準入條件
美國
必須要取得美國食品和藥物管理局FDA注冊認證才可以在美國本土市場進行銷售。
防護服分類:
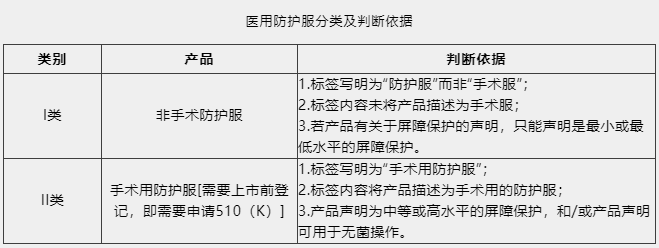
美國醫用防護服可分為非手術防護服和手術用防護服兩類。
非手術防護服屬于I類醫療器械,免于上市前登記,直接進行機構注冊。而手術用防護服屬于II類醫療器械,需要進行上市前登記,即需要申請FDA 510(K)。I類和II類醫用防護服的判斷依據見下表。
2004年,FDA認可了美國國家標準學會/美國醫療器械促進協會標準ANSI/AAMI PB70《醫療保健設施中使用的防護服和防護布的液體阻擋層性能和分類》。企業申請上市前登記,一般都需要根據ANSI/AAMI PB70對防護服進行性能測試。
歐盟
須獲得歐盟CE認證,并符合技術法規:(EU)2016/425
2016年3月9日,歐盟通過了個人防護裝備(PPE)法規(EU) 2016/425,該法規撤銷并替代了PPE指令89/686/EEC,于2018年4月21日正式實施,并指出2019年4月21日之后投放市場的產品必須滿足(EU)2016/425中所有的要求,該法規覆蓋防護服、呼吸防護設備、手套等防護產品的安全監管。
此期限,出口外貿企業和生產企業須重點注意。
根據法規(EU)2016/425第8條,出口歐盟的防護服制造商需要:
確保其產品符合法規附件Ⅱ列出的基本健康及安全要求;
撰寫法規附件Ⅲ所述的技術文件;
進行適用的合規評估程序;
撰寫歐盟合規聲明;
按照法規在產品貼附CE標記;
在個人保護裝備標明制造商的名稱、注冊商號或注冊商標、地址等;
確保個人保護裝備附有類型、批次或序列編號,以便識別;
撰寫使用說明,與個人防護裝備一并提供。說明書必須包含制造商的名稱及地址,以及可以連接到歐盟合規聲明的互聯網址。若歐盟合規聲明是隨個人防護裝備附上,說明書則無需包含互聯網址。
個人防護裝備投放市場后10年內,制造商必須保存其技術文件及歐盟合規聲明。
日本
如果需要投放市場產品必須滿足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,
TOROKU注冊系統要求國外的制造商必須向PMDA注冊制造商信息。
日本的政府機構主要是制定法律法規和進行宏觀管理,具體業務工作很多都交給各類行業協會來做。防護服涉及的主要行業協會為日本安全設備協會(JSAA)和日本防護服協議會(JPCA)。
日本安全設備協會(JSAA)網址:
http://jsaa.or.jp/
日本防護服協議會(JPCA)網址:
http://bougofuku.net/index.html
日本醫藥品和醫療器械綜合機構(PMDA)網址:
www.pmda.go.jp
韓國
韓國醫療器械準入的法規門檻,基本分類為I、II、III、IV類,持證為韓國公司(License holder),韓國收貨人需要到韓國藥監局Korea Pharmaceutical Traders Association. 提前備案進口資質(沒有不行)。
網址:www.kpta.or.kr。
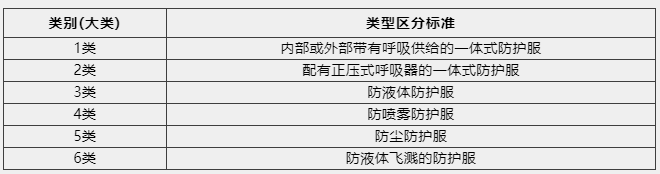
2020年1月15日,韓國勞動部2020-35號公告《防護設備安全認證通知》內給出了化學物質防護服、防塵口罩等性能標準和測試方法。根據《防護設備安全認證通知》內的防護服性能標準內容,防護服共分為六大類(其中第一類又分為5小類),類別見下表:
澳大利亞
須通過澳洲的TGA注冊,TGA 是Therapeutic Goods Administration的簡寫,全稱是治療商品管理局。
澳大利亞對醫療器械分為I類,Is and Im, IIa, IIb, III類,分別為豁免、備案和注冊。無論哪類醫療器械,其上市銷售前必須得到澳大利亞政府的準許,符合醫療器械的基本要求,按照符合性審查程序進行審查。
特別提醒:澳大利亞已與歐盟達成互認協議。這意味著,合格評定證書由TGA頒發的也被歐盟認可,TGA也認可歐盟CE認證。已獲CE認證的用戶,可提交CE證書及相關資料,獲得TGA證書。
如果產品已經注冊或備案,制造商更換經銷商對其沒有影響。對國外產品進行注冊審批后,每年還要常規注冊一次,說明產品型號、性能及質量有無變化。TGA 全權負責對醫療器械的符合性評價,并收取一定費用,相關費用金額可參見 TGA的網站。
澳大利亞治療商品管理局(TGA)官網網址:
1 禁限管理
目前商務部未對防護服設置貿易管制要求,中國海關也無針對防護服物資的監管證件口岸驗核要求。
2 出口資質
國內出口貿易企業需具備的資質和材料:
1.營業執照(經營范圍有相關經營內容)。
2.企業生產許可證(生產企業)。
3.產品檢驗報告(生產企業)。
4.醫療器械注冊證(非醫用不需要)。
5.產品說明書(跟著產品提供)、標簽(隨附產品提供)。
6.產品批次/號(外包裝)。
7.產品質量安全書或合格證(跟著產品提供)。
8.產品樣品圖片及外包裝圖片。
9.貿易公司須取得海關收發貨人注冊備案。
國內生產企業出口資質證明:
生產醫用防護服用于出口,中國海關不需要企業提供相關資質證明文件,但一般進口國會要求生產企業提供產品三證,以證明該進口的商品在中國已合法上市,具體如下:
1.營業執照(經營范圍包含有醫療器械相關)。
2.醫療器械產品備案證或者注冊證。
3. 廠家檢測報告。
生產企業有進出口權,可以自行出口,如沒有進出口權,可以通過外貿代理進行出口銷售。
3 商品歸類
除特殊情況外,絕大部分防護服按照材質分類應歸入下列稅號:
4 出口退稅
防護服的出口退稅率為13%。
5 原產地優惠
中國已經和25個國家或地區簽署了17個自由貿易協定,中國原產的商品,包括疫情防控物資,出口到這些國家和地區憑優惠原產地證書可以獲得關稅減免優惠。
以出口防護服到韓國為例,可以看到關稅減免的幅度是很大的,所以建議出口前向海關申請原產地證書。
6 產品準入條件
美國
必須要取得美國食品和藥物管理局FDA注冊認證才可以在美國本土市場進行銷售。
防護服分類:

美國醫用防護服可分為非手術防護服和手術用防護服兩類。
非手術防護服屬于I類醫療器械,免于上市前登記,直接進行機構注冊。而手術用防護服屬于II類醫療器械,需要進行上市前登記,即需要申請FDA 510(K)。I類和II類醫用防護服的判斷依據見下表。
2004年,FDA認可了美國國家標準學會/美國醫療器械促進協會標準ANSI/AAMI PB70《醫療保健設施中使用的防護服和防護布的液體阻擋層性能和分類》。企業申請上市前登記,一般都需要根據ANSI/AAMI PB70對防護服進行性能測試。
歐盟
須獲得歐盟CE認證,并符合技術法規:(EU)2016/425
2016年3月9日,歐盟通過了個人防護裝備(PPE)法規(EU) 2016/425,該法規撤銷并替代了PPE指令89/686/EEC,于2018年4月21日正式實施,并指出2019年4月21日之后投放市場的產品必須滿足(EU)2016/425中所有的要求,該法規覆蓋防護服、呼吸防護設備、手套等防護產品的安全監管。
此期限,出口外貿企業和生產企業須重點注意。
根據法規(EU)2016/425第8條,出口歐盟的防護服制造商需要:
確保其產品符合法規附件Ⅱ列出的基本健康及安全要求;
撰寫法規附件Ⅲ所述的技術文件;
進行適用的合規評估程序;
撰寫歐盟合規聲明;
按照法規在產品貼附CE標記;
在個人保護裝備標明制造商的名稱、注冊商號或注冊商標、地址等;
確保個人保護裝備附有類型、批次或序列編號,以便識別;
撰寫使用說明,與個人防護裝備一并提供。說明書必須包含制造商的名稱及地址,以及可以連接到歐盟合規聲明的互聯網址。若歐盟合規聲明是隨個人防護裝備附上,說明書則無需包含互聯網址。
個人防護裝備投放市場后10年內,制造商必須保存其技術文件及歐盟合規聲明。
日本
如果需要投放市場產品必須滿足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,
TOROKU注冊系統要求國外的制造商必須向PMDA注冊制造商信息。
日本的政府機構主要是制定法律法規和進行宏觀管理,具體業務工作很多都交給各類行業協會來做。防護服涉及的主要行業協會為日本安全設備協會(JSAA)和日本防護服協議會(JPCA)。
日本安全設備協會(JSAA)網址:
http://jsaa.or.jp/
日本防護服協議會(JPCA)網址:
http://bougofuku.net/index.html
日本醫藥品和醫療器械綜合機構(PMDA)網址:
www.pmda.go.jp
韓國
韓國醫療器械準入的法規門檻,基本分類為I、II、III、IV類,持證為韓國公司(License holder),韓國收貨人需要到韓國藥監局Korea Pharmaceutical Traders Association. 提前備案進口資質(沒有不行)。
網址:www.kpta.or.kr。
2020年1月15日,韓國勞動部2020-35號公告《防護設備安全認證通知》內給出了化學物質防護服、防塵口罩等性能標準和測試方法。根據《防護設備安全認證通知》內的防護服性能標準內容,防護服共分為六大類(其中第一類又分為5小類),類別見下表:

澳大利亞
須通過澳洲的TGA注冊,TGA 是Therapeutic Goods Administration的簡寫,全稱是治療商品管理局。
澳大利亞對醫療器械分為I類,Is and Im, IIa, IIb, III類,分別為豁免、備案和注冊。無論哪類醫療器械,其上市銷售前必須得到澳大利亞政府的準許,符合醫療器械的基本要求,按照符合性審查程序進行審查。
特別提醒:澳大利亞已與歐盟達成互認協議。這意味著,合格評定證書由TGA頒發的也被歐盟認可,TGA也認可歐盟CE認證。已獲CE認證的用戶,可提交CE證書及相關資料,獲得TGA證書。
如果產品已經注冊或備案,制造商更換經銷商對其沒有影響。對國外產品進行注冊審批后,每年還要常規注冊一次,說明產品型號、性能及質量有無變化。TGA 全權負責對醫療器械的符合性評價,并收取一定費用,相關費用金額可參見 TGA的網站。
澳大利亞治療商品管理局(TGA)官網網址:
www.tga.gov.au
文章來源于網絡,僅供參考,如有侵權,請聯系,內容屬作者個人觀點。不代表官方立場。
下一篇:洗手液出口需要哪些資料及資質?
推薦閱讀






